Historique:
On trouve la première réfèrence d'un processus chromatographique dans l'Ancien Testament qui fait mention de propriétés adsorptives de certaines variétés de bois pour adoucir de l'eau amère. Ce sont les tanins hydrophobes qui constituaient une phase stationnaire apolaire (Chromatographie d'adsorption).
Aristote décrit les propriétés que possèdent certaines terres pour purifier l'eau de mer. Les phénomènes mis en jeu révèlent ici de l'échange d'ions.
En 1906, un botaniste russe Mikhail Semenovich TSWETT inventa lachromatographie par adsorption. Il procéda de la manière suivante:
Il verse dans une colonne de verre remplie de carbonate de calcium finement pulvérisé un extrait de feuilles vertes à l'éther de pétrole, puis il ajoute une certaine quantité du même solvant pur. Il constate ainsi, que le pigment végétal, d'abord retenu au sommet du récipient, se divise en plusieurs zones en descendant le long de la colonne, à des vitesses différentes, à mesure que le solvant s'écoule au travers du carbonate de calcium, produit adsorbant retenant les substances à sa surface. Ainsi apparaissent successivement une zone jaune pâle d'allure lente, deux zones vertes et trois jaune. Il donne alors à ce phénomène de séparation le nom de chromatographie (du grecKhrôma, couleur et graphein, écrire) définit comme l'enregistrement graphique des couleurs.

En 1941, Archer John Porter MARTIN et Richard Laurence Millington SYNGEpublient la théorie de la chromatographie de partage sur gel de silice:
En 1938, afin d'étudier les acides aminés constituant la laine, ils réalisent des travaux sur la distribution des acétyl-amino-acides entre l'eau et le chloroforme. Ils imaginent ainsi un dispositif d'extraction fractionnée. La phase aqueuse est fixée à demeure sur une colonne de gel de silice qui peut retenir de 50 à 100% de son poids d'eau. Sur cette colonne, il fait traverser une solution des composés à séparer, en l'occurrence des dérivés acétylés d'acides aminés mélangés avec du chloroforme et du butanol.Il réalisent ensuite des extractions successives.
1944 CONSDEN, GORDON et MARTIN inventent la chromatographie de partage sur papier (le papier servant de support de la phase stationnaire) . Le principe consiste à plonger l'extrémité d'une bande de papier filtre dans un solvant organique saturé d'eau. On dépose à cette extrémité une goutte de la solution à analyser : par capillarité, la phase mobile avance sur le papier. Au fur et à mesure que le solvant progresse, les constituants du soluté se répartissent suivant leur coefficient de partage entre le solvant et l'eau retenue par la cellulose du papier.
1948 Archer John Porter Martin avec la collaboration du Dr A. T. James met au point la chromatographie en phase gazeuse pour séparer des mélanges d'acides et d'amines.
Principe:
La chromatographie est une technique analytique qui permet la séparation des constituants d'un mélange en phase homogène liquide ou gazeuse.
Le principe repose sur l'équilibre de concentrations des composés présents entre deux phases en contact : la phase stationnaire (emprisonnée dans la colonne) et laphase mobile (l'éluant) qui se déplace.
La séparation est basée sur l'entraînement différentiel des constituants présents dans la colonne. Ces derniers la parcourent avec des temps proportionnels à leurs propriétés intrinsèques (taille, structure, ...) ou à leur affinité avec la phase stationnaire (polarité, ...). A leur arrivée en bout de colonne, le détecteur mesure en continu la quantité de chacun des constituants du mélange.
Le principe repose sur l'équilibre de concentrations des composés présents entre deux phases en contact : la phase stationnaire (emprisonnée dans la colonne) et laphase mobile (l'éluant) qui se déplace.
La séparation est basée sur l'entraînement différentiel des constituants présents dans la colonne. Ces derniers la parcourent avec des temps proportionnels à leurs propriétés intrinsèques (taille, structure, ...) ou à leur affinité avec la phase stationnaire (polarité, ...). A leur arrivée en bout de colonne, le détecteur mesure en continu la quantité de chacun des constituants du mélange.
Le type de support utilisé pour la séparation des constituants d'un échantillon permet de distinguer plusieurs types de chromatographie:
La chromatographie d'absorption (interraction chimique)La chromatographie de partage (solubilité dans l'une des 2 phases)La chromatographie d'affinité (reconnaissance par forme)La chromatographie d'échange ionique (force ionique)La chromatographie de filtration (exclusion par taille)
La chromatographie d'adsorption:
On la définie également comme une chromatographie solide-liquide car elle est basée sur une séparation des solutés au moyen de 2 forces opposées:
La rétention par adsorption sur la phase stationnaire.
L'entrainement par le courant de l'éluant sur la phase mobile.
L'adsorption est un phénomène de surface lié à la polarité des molécules.
 Lors du passage du soluté, des interractions polaires s'effectuent entre celui-ci et la silice tandis que l'éther de pétrole (apolaire) passe sans éluer la molécule du soluté.
Lors du passage du soluté, des interractions polaires s'effectuent entre celui-ci et la silice tandis que l'éther de pétrole (apolaire) passe sans éluer la molécule du soluté.
L'adsorption est un phénomène de surface lié à la polarité des molécules.
 Lors du passage du soluté, des interractions polaires s'effectuent entre celui-ci et la silice tandis que l'éther de pétrole (apolaire) passe sans éluer la molécule du soluté.
Lors du passage du soluté, des interractions polaires s'effectuent entre celui-ci et la silice tandis que l'éther de pétrole (apolaire) passe sans éluer la molécule du soluté.Exemple d'application:
La technologie CCM ou chromatographie sur couche mince.
Avantage:
Simple et rapide à mettre en oeuvre
Coût faible
Analyse qualitative uniquement
Principe:
On utilise pour la phase mobile un solvant ou un mélange de solvants et pour la phase stationnaire un adsorbant (comme une couche d'environ 0,25mm de géle de silice, l'alumine, le kieselguhr ou la cellulose) avec un liant (comme le sulfate de calcium hydraté, l'amidon ou un polymère organique) permettant ainsi la fixation de celui-ci sur une plaque de verre, d'aluminium ou de plastique. L'échantillon (environ un microlitre de solution diluée (2 à 5%) du mélange à analyser) est déposé ponctuellement sur la plaque. Les constituants de l'échantillon sont élués par la phase mobile qui grimpe par capillarité vers le haut de la plaque. Ils peuvent être identifiés par comparaison avec l'élution simultanée de témoins.
Protocole expérimental:
La préparation de l'échantillon se fait par l'intermédiaire de solvants volatils qui peut être différent de l'éluant. Les solvants les plus utilisés sont le chloroforme, la propanone et le dichlorométhane.
Le dépot de l'échantillon se fait en un point de la plaque situé à environ 1cm de la partie inférieure à l'aide d'une micropipette ou d'un tube capillaire en appuyant légèrement et briévement l'extrémité de la pipette sur la couche adsorbant. Le dépot ne doit pas dépasser 3mm de diamétre.
Préparation de la cuve et mise en place de la plaque dans le cas de la chromatographie ascendante:
on verse l'éluant à environ 0,5 cm du fond de la cuve. la plaque est ensuite placée en position verticale dans la cuve et l'éluant qui en recouvre le fond monte par capillarité. on place un papier absorbant et on ferme la cuve de manière à former un environnement saturant de vapeur afin d'éviter l'évaporation de l'éluant lors de son ascension le long de la plaque.
La migration: pendant la migration, la cuve doit demeurer fermée et ne pas être déplacée. Lorsque la position du front du solvant arrive à environ 1cm de l'extrémité supérieure, la plaque est retirée de la cuve, le niveau atteint par le solvant est marqué par un trait fin, puis la plaque est séchée à l'air libre ou à l'aide d'un séchoir.
NB: Attention dans le choix de l'éluant:
Un éluant trop polaire entraine tous les constituants de l'échantillon. Aucune séparation n'est effectuée.
Un éluant trop apolaire n'entraine pas assez les constituants de l'échantillon. les spots obtenus risquent d'être un mélange de constituants de l'échantillon.
La révélation:
Si les composants de l'échantillon sont colorés, il facile de les repèrer sur la plaque.
Si les composants de l'échantillon sont invisibles, on les rend visibles par des méthodes usuelles de révélation comme la radiation UV, la fluorescence, l'iode ou l'atomisation.
La méthode par la radiation UV est une méthode de révélation non destructive. Les composants de l'échantillon apparaissent sous forme de taches brillantes. On peut également incorporer un indicateur fluorescent à l'adsorbant. Lors de la révélation au radiation UV, la plaque entière devient fluorescente tandis que les composants de l'échantillon apparaissent sous forme de taches sombre.
La méthode par exposition de la plaque aux vapeurs d'iode est une méthode non destructive. La plaque est placée dans un atmosphère saturé en vapeur d'Iode. Les composants apparaissent sous forme de taches brunes par fixation réversible de l'Iode. La coloration est labile et disparaît après élimination des vapeurs d'Iode.

Chromatographie sur couche mince
envoyé par soschimie
La chromatographie de partage:
On la définie également comme une chromatographie liquide-liquide ou liquide gazeux.Cette chromatographie est fondée sur la répartition différentielle de chacun des solutés entre deux liquides non miscibles, l'un constituant la phase stationnaire, l'autre la phase mobile. On joue sur la notion se solubilité.
C'est une technique qualitative.
Principe de partage:
Lorsque l'on ajoute un composé dans un milieu comprenant deux phase liquides non miscibles en contact, celui-ci va se répartir dans ces deux phases dans desproportions bien définies dépendantes de son coefficient de partage K entre ces deux phases. Ce coefficient est une constante thermodynamique d’équilibre définie à une température T et à un pH donné, relative à l'équilibre suivant :

on a alors :
K=K°(T)= [concentration dans la phase 2] / [ concentration dans la phase 1]
La chromatographie de partage peut se réaliser selon 2 types de polarité de phase:
La polarité de phase normale
La polarité de phase inverse
Dans le cas de la polarité de phase normale, la phase stationnaire est hydrophile et la phase mobile (l'éluant) est hydrophobe.
Dans le cas de la polarité de phase inverse, la phase stationnaire est hydrophobe et la phase mobile (l'éluant) est hydrophyle.
NB:
La phase stationnaire peut être constituée par un film liquide imprégné sur un support rigide ou fixé (gel de silice) par liaison covalente (phases greffées). Le greffage est réalisé par silanisation créant ainsi des ponts siloxane (Si-O-Si) .
La chromatographie de partage peut se réaliser selon 2 types de polarité de phase:
La polarité de phase normale
La polarité de phase inverse
Dans le cas de la polarité de phase normale, la phase stationnaire est hydrophile et la phase mobile (l'éluant) est hydrophobe.
Dans le cas de la polarité de phase inverse, la phase stationnaire est hydrophobe et la phase mobile (l'éluant) est hydrophyle.
NB:
La phase stationnaire peut être constituée par un film liquide imprégné sur un support rigide ou fixé (gel de silice) par liaison covalente (phases greffées). Le greffage est réalisé par silanisation créant ainsi des ponts siloxane (Si-O-Si) .

Exemple d'application:
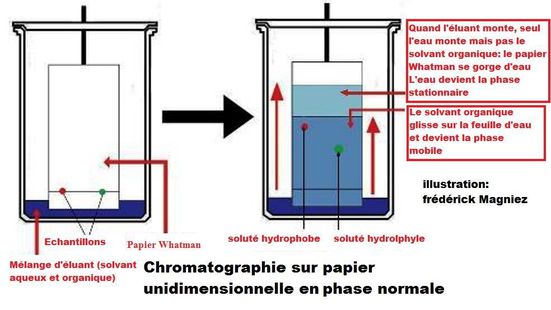
La chromatographie sur papier unidimensionnelle en polarité de phase normale
Principe:
La phase mobile est le plus souvent un solvant organique et l'eau .La phase stationnaire est constituée par l'eau elle même, absorbée par la cellulose du papier ou liée chimiquement à elle. Comme en chromatographie sur couche mince, l'échantillon, mis en solution, est déposé en un point repère du papier et le solvant qui se déplace par capillarité fait migrer les composants de l'échantillon à des vitesses variables selon leur solubilité. Généralement, les composés les plus solubles dans l'eau ou ceux qui forment facilement des associations par liaisons hydrogène sont fortement retenus par la phase stationnaire et migrent donc lentement.
utilisation:La chromatographie sur papier est employée principalement pour l'analyse de composés très polaires, tels que les acides aminés, les sucres et les composés polyfonctionnels.
Inconvénients:
Ses plus grands inconvénients par rapport à la chromatographie sur couche mince sont :
La chromatographie sur papier unidimensionnelle en polarité de phase normale
Principe:
La phase mobile est le plus souvent un solvant organique et l'eau .La phase stationnaire est constituée par l'eau elle même, absorbée par la cellulose du papier ou liée chimiquement à elle. Comme en chromatographie sur couche mince, l'échantillon, mis en solution, est déposé en un point repère du papier et le solvant qui se déplace par capillarité fait migrer les composants de l'échantillon à des vitesses variables selon leur solubilité. Généralement, les composés les plus solubles dans l'eau ou ceux qui forment facilement des associations par liaisons hydrogène sont fortement retenus par la phase stationnaire et migrent donc lentement.
utilisation:La chromatographie sur papier est employée principalement pour l'analyse de composés très polaires, tels que les acides aminés, les sucres et les composés polyfonctionnels.
Inconvénients:
Ses plus grands inconvénients par rapport à la chromatographie sur couche mince sont :
- une durée de développement beaucoup plus longue
- une séparation généralement moins bonne.
Ps: l'utilisation de papiers spécifiques est fortement recommandé car ceux-ci possédent un faible taux d'impuretés et des caractéristiques physiques uniformes.
exemples : papier Whatman;Schleider; Shüll; Durieux; Arches.