L'étude des fonctions d'un gène passe par 3 étapes différentes:
L'intérêt d'étudier la fonction d'un gène est multiple:
permet d'identifier des séquences régulatrices (emplificateur),
La thérapie génique.
Les obstacles à une telle étude sont:
Différents types de traitement pour immortaliser les cellules:
Le transfert de gènes:
- Isolement , clonage et séquençage du gène,
- manipulation in vitro sur le gène provoquant des mutations,
- réintroduction du gène modifié dans les cellules pour étudier sa fonction. On qualifie cette réintroduction sous le terme de transfection cellulaire.
L'intérêt d'étudier la fonction d'un gène est multiple:
permet d'identifier des séquences régulatrices (emplificateur),
La thérapie génique.
Les obstacles à une telle étude sont:
Les cellules de mammifères sont refractaires à la transfection. On a de très faibles pourcentages de cellules transfectées.
les cellules normales n'ont pas une tendance à se multiplier à haute fréquence. Ce dernier fut résolu grâce aux lignées cellulaires qui possèdent la particularité de se multiplier rapidement et indéfiniment. ces cellules dérivent de lignées tumorales. Elle présentent néanmoins des propriétés différentes aux cellules normales.
On peut également utiliser des cellules immortalisées. Ce sont des cellules normales traitées de façon qu'elles se multiplient rapidement.
les cellules normales n'ont pas une tendance à se multiplier à haute fréquence. Ce dernier fut résolu grâce aux lignées cellulaires qui possèdent la particularité de se multiplier rapidement et indéfiniment. ces cellules dérivent de lignées tumorales. Elle présentent néanmoins des propriétés différentes aux cellules normales.
On peut également utiliser des cellules immortalisées. Ce sont des cellules normales traitées de façon qu'elles se multiplient rapidement.
Différents types de traitement pour immortaliser les cellules:
- Par un oncogène,
- Par un virus (polyome, SV40, virus du Sarcome de Rous, virus d'Epstein-bar...).
- Par un produit chimique tel qu'un agent mutagène (nitrosoguanidine, méthanesulfonate d'éthyl...).
Le transfert de gènes:
On peut utiliser des virus tumorigènes qui infectent les cellules de mammifères. Ils s'intégrent dans le génome de ces cellules et détournent la machinerie cellulaire à leur profit. En effet, du fait de leur simplicité extrême, les virus ne peuvent pas se multiplier, du moins se multiplier par eux-mêmes. Pour éviter la lyse cellulaire, on veillera à ce que le génome virale s'intégre au génome de la cellule. La cellule deviendra ainsi tumorale.Le virus sert de vecteur au gène d'intérêt en l'incorporant dans le gènome de celui-ci.
La technologie faisant appel à l'utilisation d'ADN recombinant, de plasmide et d'enzyme de restriction. Dans cette voie, les cellules étaient réfractaires à l'introduction de plasmide. De nombreux laboratoires ont essayé de faciliter l'introduction par différentes méthodes:
- L'électroporation: les cellules sont soumis à un champ électrique. Les impulsions électriques produisent un potentiel transmembranaire provoquant une rupture réversible de la membran cellulaire. Des pores se forment et permettent au plasmide de pénétrer dans la cellule.
- La micro-injection directe de l'ADN grâce à des micro-pipettes. Cette méthode est lourde à entreprendre sachant qu'un fragment d'ADN doit être injecté dans 100 cellules eucaryotes.
- Association de l'ADN et d'une colonne DEAE (diéthylaminoéthyl). Ce géle montre des charges positives permettant de fixer l'ADN (chargé négativement). On introduit ensuite les cellules dans cette colonne et on provoque un choc thermique. Des pores apparaissent dans la membrane plasmique de ces cellules permettant l'introduction de l'ADN. Beaucoup de cellules sont réfractaires à ce système.
- Utilisation du phosphate de calcium: l'ADN étranger se trouve en solution avec du phosphate de calcium. Cet ADN va alors co-précipiter avec les cristaux tricalciques, et ainsi être protégé des nucléases. De plus cette précipitation à l’avantage d’augmenter le contact avec les cellules cibles. Ce contact entre la cellule et le co-précipité va induire une endocytose, et ainsi permettre l’introduction de l’ADN étranger dans la cellule cible. Cette technique est relativement simple à réaliser. Son rendement est bon mais elle acidifie le milieu de culture, et peut être toxique à plus ou moins long terme.
- Utilisation de liposomes qui sont des vésicules artificielles formées par des bicouches phospholipidiques. Ils mesurent quelques dizaines à quelques milliers de nm de diamètre. L'association avec l'ADN se fait par interaction électrostatique entre les groupes phosphates de l'ADN chargés négativement et les têtes polaires des lipides cationiques chargées positivement. On obtient un vecteur qui au contact des cellules, pénétre dans celles-ci. La pénétration intracellulaire reste pour le moment mal connue. En dehors de l'endocytose, d'autres mécanismes semblent possibles. Dans le cytoplasme de la cellule, le liposome se dissocie, libérant l'ADN. L'utilisation des liposomes présente des inconvénients importants, le rendement faible de la pénétration intracellulaire et dans le noyau (transfection stable).
Dans le cas de la transfection par le biais d'un virus:
Les cellules eucaryotes infectées par un virus sont facilement observables car elles produisent des particules virales.
Les cellules eucaryotes infectées par un virus sont facilement observables car elles produisent des particules virales.
Dans le cas d'une transfection par le biais d'un plasmide:
L'utilisation d'un plasmide pour la transfection cellulaire rend impossible l'identification des cellules ayant reçu la tranfection sachant que le taux de réussite est très faible. Pour répondre à ce problème, nous utilisons une partie du génome du virus de l'herpès ( HSV pour Herpes Simplex Virus), et plus particulièrement le gène TK qui code pour lathymidine kinase (enzyme qui phosphoryle la thymidine). Cette enzyme est indispensable pour la réplication des virus.
Ce gène est associé au gène de la beta globine servant de site de restriction pour l'enzyme KPN1.
L'ensemble est ensuite mis en contact avec des cellules déficientes pour le gène TK (paramétre limite) et en présence de phosphate de calcium (transfection cellulaire).
Les cellules poussent dans un milieu sélectif. Seules les cellules possédant le gène TK poussent c'est à dire les cellules transfectées.On obtient des clones que l'on sépare. On procède ensuite a l'extraction de l'ADN de ces clones.
L'ADN ainsi prélevé, on procède à sa digestion en utilisant l'enzyme de restriction KPN1 qui coupe au niveau du gène de la globine. On obtient des fragments d'ADN. Ceux-ci sont séparés par électrophorèse puis transférés sur une membrane de nitrocellulose. On procède enfin à l'hybridation moléculaire en utilisant une sonde radioactive de la beta globine (technique du southern blot).
Cette technique ne s'adresse qu'aux cellules déficientes pour le gène TK.
Ce gène est associé au gène de la beta globine servant de site de restriction pour l'enzyme KPN1.
L'ensemble est ensuite mis en contact avec des cellules déficientes pour le gène TK (paramétre limite) et en présence de phosphate de calcium (transfection cellulaire).
Les cellules poussent dans un milieu sélectif. Seules les cellules possédant le gène TK poussent c'est à dire les cellules transfectées.On obtient des clones que l'on sépare. On procède ensuite a l'extraction de l'ADN de ces clones.
L'ADN ainsi prélevé, on procède à sa digestion en utilisant l'enzyme de restriction KPN1 qui coupe au niveau du gène de la globine. On obtient des fragments d'ADN. Ceux-ci sont séparés par électrophorèse puis transférés sur une membrane de nitrocellulose. On procède enfin à l'hybridation moléculaire en utilisant une sonde radioactive de la beta globine (technique du southern blot).
Cette technique ne s'adresse qu'aux cellules déficientes pour le gène TK.
Le marqueur génétique idéal doit permettre de sélectionner un caractère génique qui s'exprimera dans toutes les cellules choisies. Le gène marqueur aph (aminoglycoside phosphotransférase) est un gène bactérien qui confère la résistance à une substance apparentée à la néomycine, le G418 (généticine) qui tue les cellules de mammifères en bloquant la synthèse protéique. Ce gène code pour une enzyme qui détruit cette substance.
On crée un plasmide avec le gène aph, le gène d'intérêt et un promoteur. Ce plamide est ensuite mis en contact avec les cellules en culture. Le plamide pénétre dans quelques cellules. La transfection peut soit être stable ou transitoire.
On crée un plasmide avec le gène aph, le gène d'intérêt et un promoteur. Ce plamide est ensuite mis en contact avec les cellules en culture. Le plamide pénétre dans quelques cellules. La transfection peut soit être stable ou transitoire.
- Dans le cas d'une transfection stable, les rares cellules transfectées qui intégrent l'ADN exogène dans leur génome sont selectionnées sur un milieu contenant du G418 (les autres cellules non transfectées meurent). Ces cellules ayant subi une transfection stable continueront à produire la protéine codée par l'ADNc tant que la culture sera maintenue.
- L'obtention des transfectants stables n'est pas toujours évident d'où le passage àdes transitoires. Dans ce cas là, on ne laisse pas le temps au plasmide de s'intégrer au génome. On lyse les cellules et on récupére leur contenu.
- En 48 heures de culture, on a suffisament d'ARN synthétisé par le gène exogène.
Il convient d'utiliser un vecteur d'expression efficace. Il doit contenir:
- Un gène de la résistance à l'antibiotique à l'ampicilline.
- Un promoteur puissant comme le promoteur du gène précoce du cytomégalovirus humain (CMV).
- Un gène d'intérêt intégré au niveau du polylinker.
- Une séquence de meilleur arrêt de transcription.
- Un séquence de meilleur traduction.
- Une séquence intronique ( utilisée par la machinerie cellulaire lors de la maturation) afin d'assurer une meilleure transcription.
La transfection transitoire permet d'étudier le taux d'expression d'un gène.
L'expression d'un gène dépend de son promoteur. Si le promoteur n'est pas fort, la transcription reste difficile à détecter.
A ce promoteur faible, on ajoute un gène rapporteur ("reporter"). Quand le gène rapporteur sera exprimé en ARNm puis traduit en protéine, cette dernière sera facilement détectable par des tests. On pourra déterminer le taux de la protéine et donc en déduire la force du promoteur.
L'expression d'un gène dépend de son promoteur. Si le promoteur n'est pas fort, la transcription reste difficile à détecter.
A ce promoteur faible, on ajoute un gène rapporteur ("reporter"). Quand le gène rapporteur sera exprimé en ARNm puis traduit en protéine, cette dernière sera facilement détectable par des tests. On pourra déterminer le taux de la protéine et donc en déduire la force du promoteur.
Exemple de gène rapporteur:
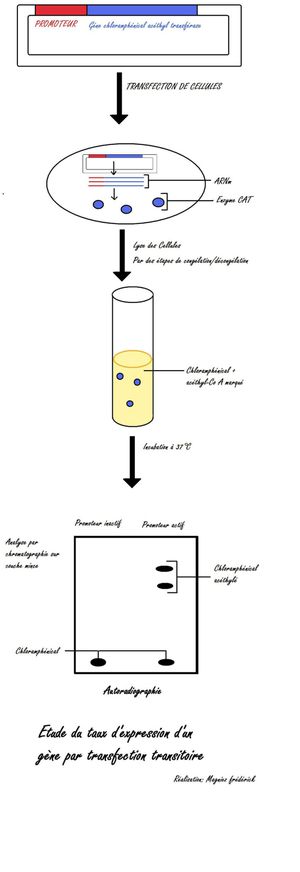 Le gène CAT (Chloremphenical Acetyl Transférase). Ce gène code pour une enzyme qui transfecte l'acétyl sur le chloremphenical.
Le gène CAT (Chloremphenical Acetyl Transférase). Ce gène code pour une enzyme qui transfecte l'acétyl sur le chloremphenical.Le plasmide possédant le promoteur a étudier et le gène rapporteur est mis en contact avec les cellules en culture. Après 48h, on lyse les cellules par des cycles de congélation/décongélation. Ces lysats sont ensuite mélangés avec du chloramphenical radioactif et de l'acétyl coenzyme A. L'enzyme Chloremphenical Acetyl Transférase transfére le groupe acétylé de l'acétyl CoA sur les positions 2 ou 3 du chloramphenical. La réaction est suivie par chromatographie en couche mince qui permet de séparer le chloramphenical acétylé de la forme non acétylé. les formes de chloramphenical acétylé montent plus haut que la forme non acéthylé.
On visualise les produits de la réaction par autoradiographie.
on observe un seul signal correspondant au chloramphenical non acetylé traduisant que le promoteur n'est pas actif et 3 signaux correspondant aux 2 formes acétylés et la forme non acétylé du chloramphenical.
On notera que plus le signal autoradiographique est fort et plus la transcription est fort. Ceci traduit l'activité réelle du promoteur.
On peut également utiliser comme gène rapporteur, le gène de la luciférase. Il code pour une enzyme la luciférase qui à la particularité d'oxyder la luciférine (substrat)aboutissant à la formation d'oxyluciférineet à l'émission de photons. On utilisera dans ce cas, un appareil capable de détecter la bioluminescence.
L'amplification génétique:
La transfection stable peut être également utilisée afin de réaliser de très nombreuses copies du gène d'intérêt.
On réalise dans ce cas, un plasmide comprenant le gène d'intérêt et le gène DHFR qui code pour le dihydrofotate réductase. C'est une enzyme importante pour la réplication de l'ADN et donc pour la survie des cellules.
On transfecte ce plasmide dans des cellules DHFR-. Les cellules sont ensuite cultivées dans un milieu dépourvu de nucléosides. Les cellules meurent sauf celles qui contiennent dans le génome, le gène DHFR et le gène d'intérêt (transfection stable). Des clones apparraissent. Ceux-ci sont récupérés puis mis en culture afin d'augmenter leur quantité. On dépose du méthotrexate (inhibiteur de la DHFR) à faible dose dans le milieu. Un grand nombre de cellule meurent. Les cellules qui ont pu résister sont remis en culture. L'analyse de l'ADN de ces cellules dévoile une amplification génétique du gène DHFR et des régions voisines dont le gène d'intérêt. On procéde à chaque étape de culture à l'augmentation progressive de la concentration du méthotrexate afin d'obtenir une succession de copie du gène DHFR et du gène d'intérêt.