Histoire:
La technique d'ELISA a été conceptualisée et développée par 2 scientifiques suédois, Peter Perlmann(investigateur principal) et Eva Engvall à l'Université de Stockholm en 1971.
A la fin des années 60, Stratis Avrameas et GB Pierce mettent au point la technique d'immunoenzymologie, technique d'analyse par réaction entre antigènes et anticorps et utilisant comme marqueur des enzymes.
Principe:
La technique ELISA (Enzyme Linked ImmunoSorbent Assay) est une technique immuno-enzymatique de détection qui permet de visualiser une réaction antigène-anticorps grâce à une réaction colorée produite par l'action sur un substrat d'une enzyme préalablement fixée à l'anticorps.
Avantages de la technique:
- L'utilisation d'anticorps monoclonaux rend la détection spécifique.
- Possibilité de quantifier grâce à la réalisation d'une gamme en parallèle.
- L'utilisation d'anticorps secondaires rend la technique sensible.
- technique accessible à tous les biologistes.
- La détection du signal ne nécessite pas la présence d'appareillage spécialisé.
- La validité des trousses est d'environ 1 an.
- La limite de détection est moins bonne que la technique RIA.
- La réaction enzymatique rend cette technique dépendante de la température, du pH et de l'éclairement.
Ce test permet de détecter ou doser des anticorps.
il se réalise en 4 étapes:
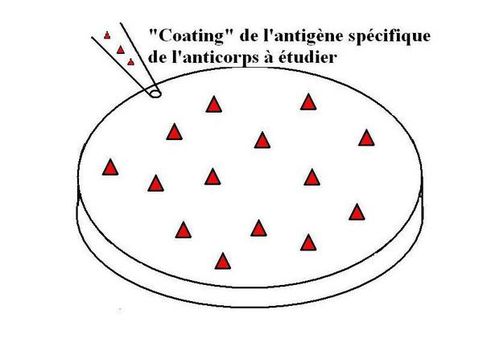
La première étape appelée "coating" de l'antigène:il se réalise en 4 étapes:
Elle consiste à incuber dans des puits, la solution d'antigène spécifique de l'anticorps recherché. La fixation de l'antigène sur le fond des puits se fait électrostatiquement. Les plaques sont incubées à 4°C pendant une nuit. Les puits sont ensuite lavés pour éliminer les antigènes en excès avec du tampon de lavage.
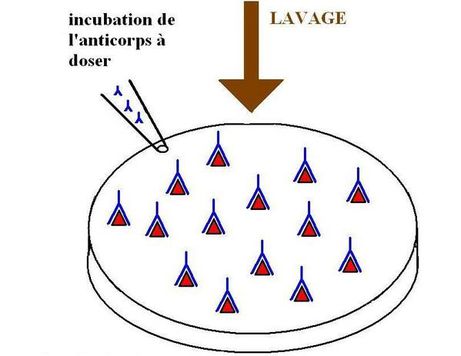
La deuxième étape consiste à fixer l'anticorps à doser:
On incube à 37°C dans les puits, la solution d'anticorps à doser pendant environ 30 minutes à 2 heures. Les anticorps se fixent spécifiquement sur l'antigène. Les puits sont ensuite lavés pour éliminer les anticorps à doser en excès avec du tampon de lavage.
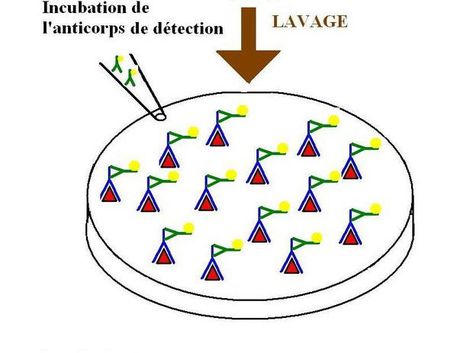
La troisième étape consiste à fixer l'anticorps de détection:
On incube à 37°C dans les puits, la solution d'anticorps de détection pendant environ 30 minutes à 2 heures. Les anticorps de détection se fixent spécifiquement sur les anticorps à doser. Les puits sont ensuite lavés pour éliminer les anticorps de détection en excès avec du tampon de lavage. Notons que les anticorps de détection sont couplés à une enzyme qui en présence de son substrat le transforme en produit de réaction détectable et mesurable grace à l'apparition d'une coloration.
La quatrième étape consiste à révéler les anticorps fixés:
On incube à température ambiante et à l'obscurité pendant 10 minutes, une solution révélatrice contenant le substrat pour l'enzyme. L'apparition d'une coloration dans le substrat indique la présence de l'anticorps à doser. L'intensité de celle-ci est proportionnelle à la quantité d'enzyme présent et donc à la concentration d'anticorps recherché.
Exemple d'application:
Identification dans le sérum du patient, les anticorps anti-protéines de l'enveloppe et du corps du virus de l'immunodéficience humaine.

Le DAS ELISA direct ou Double Antibody Sandwich ELISA direct:Dans ce cas de figure, l'antigène se trouve entre 2 anticorps spécifiques. L'utilisation de la DAS ELISA nécessite de posséder 2 anticorps monoclonaux reconnaissant des épitopes différents sur l'antigène.
La première étape consiste à fixer sur le support, l'anticorps de capture. On incube la solution à 37°C pendant 2 heures puis lavage ou une nuit à 4°C puis lavage.
Lors de la deuxième étape, on dépose l'échantillon possédant l'antigène à identifier qu'on laisse incuber à 37°C pendant 2 heures puis lavage ou une nuit à 4°C puis lavage.
Dans une troisième étape, on fixe l'anticorps de détection marqué avec une enzyme sur l'antigène recherché. Pour cela, on dépose la solution d'anticorps dans les puits puis on incube l'ensemble à 37°C pendant 2 heures.
La dernière étape, on dépose une solution révélatrice contenant le substrat pour l'enzyme et on laisse incuber pendant 30 à 120 minutes. Le produit de réaction obtenu est soluble et coloré. L'intensité de cette coloration peut être mesurée à l'aide d'un photomètre.
NB: la différence entre le DAS ELISA direct et le DAS ELISA indirect par le système biotine-streptavidine réside au niveau de l'anticorps de détection. Pour le DAS ELISA indirect par le système biotine-streptavidine, l'anticorps de détection porte une molécule de biotine qui interragie avec la streptavidine couplé à une enzyme.

La sensibilité du test DAS-ELISA direct se situe entre 1 et 10 ng/ml. Cette sensibilité peut être augmentée par l'utilisation du système indirect du fait de la forte affinité entre la streptavidine et la biotine.